RESEARCH PAPER
The mercury concentration in mushrooms (Leccinum scabrum and Amanita muscaria) collected in Poland
1
Katedra i Zakład Toksykologii i Bioanalizy, Wydział Nauk Farmaceutycznych w Sosnowcu, Śląski Uniwersytet Medyczny,
Polska
Corresponding author
Agnieszka Fischer
Katedra i Zakład Toksykologii i Bioanalizy, Wydział Nauk Farmaceutycznych w Sosnowcu, Śląski Uniwersytet Medyczny, ul. Jagiellońska 4, 41-200, Sosnowiec, Polska
Katedra i Zakład Toksykologii i Bioanalizy, Wydział Nauk Farmaceutycznych w Sosnowcu, Śląski Uniwersytet Medyczny, ul. Jagiellońska 4, 41-200, Sosnowiec, Polska
Med Srod. 2019;22(3-4):71-76
KEYWORDS
TOPICS
ABSTRACT
Objectives:
Mercury is a heavy metal which shows high reactivity and practically unlimited migration capacity. Hg may persist for a long time in the environment and may be accumulated. From natural sources and industry, Hg can be incorporated into the elements of the food chain. Biological structures are particularly sensitive to the toxic effects of Hg compounds. The exposure to Hg causes different toxic effects in the organism. Local or systemic dysfunctions may occur as a result of Hg exposure. The human central nervous system is especially sensitive to Hg, both in adults and children. Food is one of the main sources of Hg content in the human body. Picking and consumption of wild mushrooms is very popular in Poland. In the study the concentration of Hg in two species of wild mushrooms was analysed (edible – Leccinum scabrum and non-edible – poisonous – Amanita muscaria).
Material and methods:
Mushrooms were collected from 13 locations in southern Poland. The samples of the mushrooms were manually divided into morphological parts (stems and hats), then air dried. Concentration of Hg was determined using AAS method with an AMA 25 analyser.
Results:
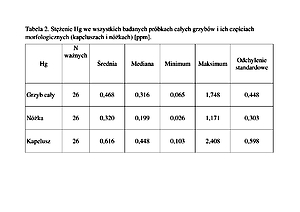
Concentration of Hg in all the tested mushrooms was 0.065–1.748 ppm (mean: 0.263 ppm in the Leccinum scabrum, 0.672 ppm in Amanita muscaria).
Conclusions:
Concentration of Hg was statistically significantly higher (p<0.05) in Amanita muscaria than in Leccinum scabrum, and was higher in the mushroom caps than in stems (in both Amanita muscaria and Leccinum scabrum).
Mercury is a heavy metal which shows high reactivity and practically unlimited migration capacity. Hg may persist for a long time in the environment and may be accumulated. From natural sources and industry, Hg can be incorporated into the elements of the food chain. Biological structures are particularly sensitive to the toxic effects of Hg compounds. The exposure to Hg causes different toxic effects in the organism. Local or systemic dysfunctions may occur as a result of Hg exposure. The human central nervous system is especially sensitive to Hg, both in adults and children. Food is one of the main sources of Hg content in the human body. Picking and consumption of wild mushrooms is very popular in Poland. In the study the concentration of Hg in two species of wild mushrooms was analysed (edible – Leccinum scabrum and non-edible – poisonous – Amanita muscaria).
Material and methods:
Mushrooms were collected from 13 locations in southern Poland. The samples of the mushrooms were manually divided into morphological parts (stems and hats), then air dried. Concentration of Hg was determined using AAS method with an AMA 25 analyser.
Results:
Concentration of Hg in all the tested mushrooms was 0.065–1.748 ppm (mean: 0.263 ppm in the Leccinum scabrum, 0.672 ppm in Amanita muscaria).
Conclusions:
Concentration of Hg was statistically significantly higher (p<0.05) in Amanita muscaria than in Leccinum scabrum, and was higher in the mushroom caps than in stems (in both Amanita muscaria and Leccinum scabrum).
REFERENCES (37)
1.
Nordberg G, Fowler B, Nordberg M. Handbook on the toxicology of metals. Elsevier Academic Press; 2014; 675-729.
2.
Cyran M. Effect of environmental exposure to mercury on the functioning of the human body. Med Środ - Environ Med. 2013; 16(3): 55-58.
3.
Klassen CD, Watkins JB, Casarett and Doull Podstawy Toksykologii, MedPharm Polska; Wrocław 2014: 450-452.
4.
Jędrucha A, Bełdowska M, Kwasigroch U. Forms of mercury in the Baltic mussel (Mytilus trossulus): Human and ecosystem health risk assessment. Environ Res. 2019; 1(79) Part A, 108755.
5.
Baran A, Jerzy Wieczorek J, Jaworska M. Zawartość rtęci w glebach województwa małopolskiego. Studia i Raporty UNG-PIB. 2015; 46(20): 143-161, doi: 10.26114/sir.iung.2015.46.08.
6.
Kot K, Kosik- Bogacka D, Łanocha- Arendarczyk N, i wsp. Wpływ związków rtęci na organizm człowieka. Farmacja Współcz. 2016; 9: 210-216.
9.
Genchi G, Sinicropi MS, Carocci A, i wsp. Mercury Exposure and Heart Diseases. Int Environ Res Public Health. 2017; 14, 74; doi:10.3390/ijerph14010074.
10.
Boszke L, Śliwińska J. Źródła rtęci w organizmach ludzi nienarażonych zawodowo na jej związki. Inż Ochr Środ. 2012; 23-42.
11.
Bjorklund G, Dadar M, Mutter J, et al. The toxicology of mercury: Current research and emerging trends. Environ Res. 2017; 159: 545-554.
12.
Ścisłowski P, Rajfur M. Mushrooms as biomonitors od heavy metals contamination in forest areas. Ecol Chem Eng S. 2018; 25(4): 557-568.
13.
Wierzbicka M. Ekotoksykologia: rośliny, gleby, metale. Wydaw Uniwersytetu Warszawskiego; Warszawa 2015.
15.
Kołodziejczyk A. Naturalne związki organiczne. Wydawnictwo Naukowe PWN; Warszawa 2013.
17.
Różycka K, Rolka G. Zastosowanie techniki ASA do oznaczania rtęci na przykładzie badań surowców używanych w przemyśle materiałów budowlanych. Prace ICiMB. 2015; 21: 58-66.
18.
Chatterjee S, Sarma MK, Deb UI, wsp. Mushrooms: from nutrition to mycoremediation. Environ Sci Pollut Res. 2017; 24: 19480–19493. doi 10.1007/s11356-017-9826-3.
19.
Gil-Martínez M, Navarro-Fernández CM, Murillo JM, i wsp. Trace elements and C and N isotope composition in two mushroom species from a mine-spill contaminated site. Sci Rep. 2020; 10: 6434. doi: 10.1038/s41598-020-63194-2.
20.
Adamiak EA, Kalembasa S, Kuziemska B. Zawartość metali ciężkich w wybranych gatunkach grzybów jadalnych. Acta Agroph. 2013; 20(1): 7-16.
21.
Sas-Golak I, Sobieralski K, Siwulski M, i wsp. Skład, wartość odżywcza oraz właściwości zdrowotne grzybów pozyskiwanych ze stanowisk naturalnych. Kosmos. 2011; 60(3-4): 483-490.
23.
Saba M, Falandysz J, Loganathan B. Accumulation pattern of inorganic elements in scaly tooth mushroom (Sarcodon imbricatus) from Northern Poland. Chem Biodivers. 2020; 17(5): e2000167. doi: 10.1002/cbdv.202000167.
24.
Siwulski M, Sobieralski K, Sas-Golak I. Wartość odżywcza i prozdrowotna grzybów. Żywność Nauka Technologia Jakość. 2014; 1(92): 16-28.
25.
Golianek A, Mazurkiewicz-Zapałowicz K. Grzyby w diecie człowieka - wartość odżywcza i prozdrowotna. Kosmos. 2016; 65(4): 513-522.
26.
Falandysz J, Drewnowska M. Cooking can decrease mercury contamination of mushroom meal: Cantharellus cibarius and Amanita fulva. Environ Sci Pollut Res. 2017; 24: 13352–13357.
27.
Król - Pakulska E, Pakulski C. Rtęć - Pierwiastek Silnie Toksyczny. Pol Prz Nauk Zdr. 2017; 4(53): 508-513.
28.
Rozporządzenie Komisji (WE) nr 1881/2006 z dnia 19 grudnia 2006 r. ustalające najwyższe dopuszczalne poziomy niektórych zanieczyszczeń w środkach spożywczych.
29.
Krajowa Komisja ds. Zdrowia i Planowania Rodziny. Maksymalne poziomy zanieczyszczeń w produktach spożywczych. Krajowy Standard Bezpieczeństwa. 2013.
30.
Mazurkiewicz N, Podlasińska J. Zawartość rtęci w grzybach wielkoowocnikowych z obszaru województwa zachodniopomorskiego. Bromat Chem Toksykol. 2014; 47(1): 114-119.
31.
Falandysz J. Mineral constituents in Leccinum scabrum from lowland locations in the central Europe and their relation to concentration in forest topsoil. J Environ Sci Health B. 2018; 3;53(8): 546-560. doi: 10.1080/03601234.2018.1462914.
32.
Zhang D, Zhang Y, Morawska E, et al. Trace Elements in Leccinum scabrum Mushrooms and Top soils from Kłodzka Dale in Sudety Mountains, Poland. J Mt Sci. 2013; 10(4): 621–627.
33.
Falandysz J, Krasińska G, Pankavec S, et al. Mercury in certain boletus mushrooms from Poland and Belarus J Environ Sci Health B. 2014; 49(9): 690-5. doi: 10.1080/03601234.2014.922853.
34.
Širić I, Humar M, Kasap A, et al. Heavy metal bioaccumulation by wild edible saprophyticand ectomycorrhizal mushrooms. Environ Sci Pollut Res. 2016; 23: 18239–18252. doi 10.1007/s11356-016-7027-0.
35.
Kavčič A, Mikuš K, Debeljak M, et al. Localization, ligand environment, bioavailability and toxicity of mercury in Boletus spp. and Scutiger pes-caprae mushrooms Ecotoxicol Environ Saf. 2019: 30(184): 109623. doi: 10.1016/j.ecoenv.2019.109623.
36.
Falandysz J, Mędyk M, Treu R. Bio-concentration potential and associations of heavy metals in Amanita muscaria (L.) Lam. from northern regions of Poland Environ Sci Pollut Res Int. 2018; 25(25): 25190–25206. doi: 10.1007/s11356-018-2603-0.
37.
Rompa M, Bielawski L, Falandysz J. Zawartość i biokoncentracja rtęci u muchomora czerwonawego (Amanita rubescens) z Polski Północnej. Rocz Panstw Zakl Hig. 2008; 59(2): 139-146.
Share
RELATED ARTICLE
We process personal data collected when visiting the website. The function of obtaining information about users and their behavior is carried out by voluntarily entered information in forms and saving cookies in end devices. Data, including cookies, are used to provide services, improve the user experience and to analyze the traffic in accordance with the Privacy policy. Data are also collected and processed by Google Analytics tool (more).
You can change cookies settings in your browser. Restricted use of cookies in the browser configuration may affect some functionalities of the website.
You can change cookies settings in your browser. Restricted use of cookies in the browser configuration may affect some functionalities of the website.